Pared celular de levadura y la respuesta del sistema inmune innato
Melina Bonato y Liliana Borges (I&D, ICC Brazil)
Los sistemas de producción avícola son altamente desafiadores, pues además de factores ambientales como temperatura, ventilación, densidad poblacional y otros agentes estresores (Rocha et al., 2014), hay, casi siempre, la presencia de patógenos y micotoxinas, que pueden llevar las aves a reducir su capacidad de respuesta inmunológica o afectarla.
Las aves poseen una gran cantidad de tejido linfoide y células del sistema inmune en la mucosa intestinal, llamado GALT (tejido linfoide asociado al intestino), y por su vez, constituye el MALT (tejido linfoide asociado a la mucosa). El GALT está continuamente expuesto a los antígenos alimentares, microflora y patógenos (Dalloul & Lillehoj, 2006), y necesita identificar los componentes que están presentes en el lumen intestinal lo que pueden ser una posible amenaza al animal.
La primera línea de defensa del sistema inmune son las células fagocíticas, entre estas, macrófagos, heterofilos (equivalentes a los neutrófilos en los mamíferos), células dendríticas y células natural killer (Sharma, 2003). Receptores del tipo Toll, localizados en la superficie de estas células inmunológicas, reconocen patrones microbianos e inducen una respuesta inmune innata inmediata. Después de esta activación y fagocitosis, el fagocito (célula que presenta el antígeno “APC”) presenta un fragmento procesado del antígeno y se inicia una respuesta en cadena contra este. El reconocimiento de patógenos por el sistema inmune innato desencadena defensas innatas inmediatas y, posteriormente, la activación de la respuesta inmune adaptativa (Lee & Iwasaki, 2007).
Es importante resaltar que esta serie de respuestas del sistema inmune innato demandan diversos nutrientes y principalmente, energía del metabolismo, ya que se trata de una respuesta inespecífica y proinflamatoria, pero necesaria para controlar la proliferación, invasión y daños causados por el antígeno en el organismo animal. Sin embargo, una respuesta proinflamatoria prolongada, puede llevar al aparecimiento de enfermedades secundarias, inmunosupresión, mantenimiento de la homeostasis inmunológica, disbiosis intestinal y, por fin, quedas en desempeño y mortalidad.
La microbiota intestinal de los animales tiene un papel importante en la regulación de la respuesta del sistema inmune, pues, además de modular varios procesos fisiológicos, nutrición, metabolismo y exclusión de patógenos, puede alterar la fisiopatología de enfermedades ofreciendo resistencia o promoviendo infecciones parasitarias entéricas. Las bacterias naturales del intestino actúan como adyuvantes moleculares que suministran inmunoestimulación indirecta ayudando al organismo a defenderse contra infecciones
De esta manera, un correcto programa de vacunación, nutrición balanceada, disminución de los factores de estrés, buenas prácticas de manejo y bien estar animal pueden disminuir considerablemente la incidencia de inmunosupresión. Sin embargo, existen algunos aditivos dietéticos que pueden ayudar en la modulación del sistema inmune innato y, por lo tanto, mejorar la respuesta de este frente a los desafíos.
La pared celular de levadura Saccharomyces cerevisiae (ImmunoWall®, ICC Brazil) oriunda del proceso de fermentación de la caña-de-azúcar para producción de etanol, contiene alrededor del 55% de carbohidratos indigestibles totales, siendo el 35% de β-glucanos (1,3 y 1,6), y el 20% de mananoligosacáridos (MOS). Los β-glucanos se reconocen por las células fagocíticas (Petravić-Tominac et al., 2010), que desencadenan una respuesta innata que puede ayudar al animal a modular su sistema inmunológico. Ya el MOS, posee una capacidad de aglutinación de patógenos que poseen fimbria tipo 1, tales como diversas cepas de Salmonella y Escherichia coli.
Un reciente estudio de Beirão et al. (2018) donde se suplementaron pollos de engorde con ImmunoWall® (0,5 kg/ton) y se los infectaron a los dos días de edad con Salmonella Enteritidis [SE] (vía oral en la dosificación de 108 UFC/ave), mostró que a los cuatro y ocho días (dos y seis días post- infección , respectivamente) ImmunoWall® redujo el pasaje del marcador (Dextran-FITC, 3-5 kD) para la sangre en las aves desafiadas. Estos resultados indican una mejora significativa en la integridad y permeabilidad intestinal, ya que SE es una bacteria capaz de adherir a la mucosa por medio de sus fimbrias, producir toxinas y causar daños a las uniones estrechas y a los enterocitos, invadiéndolos y translocándose para la corriente sanguínea y demás órganos y tejidos internos (Figura 1).
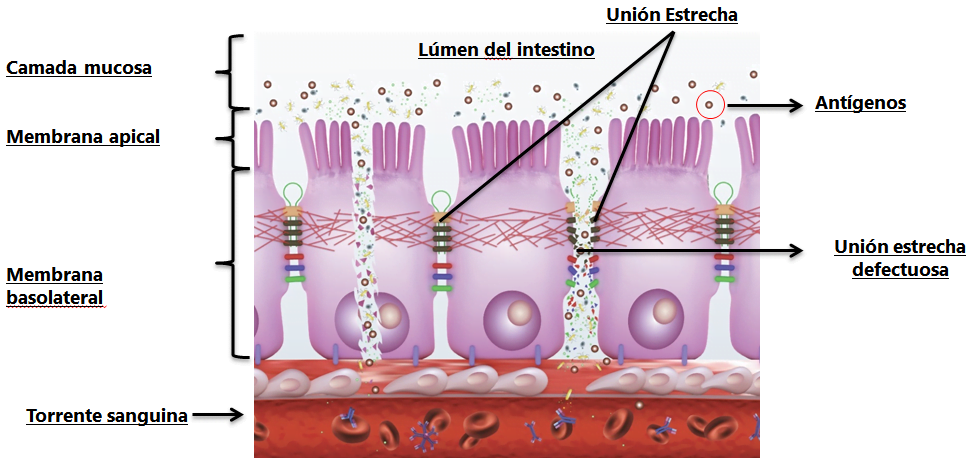
Figura 1. Dinámica del proceso de daño a las uniones estrechas por los antígenos.
Estos resultados se pueden explicar por la cuantificación de células circulantes que se analizaron en la sangre colectada de estas aves. Es importante notar que durante la dinámica normal de una infección, ocurre una movilización de los leucocitos de la sangre hacia el intestino, pero si el animal presenta otro tipo de infección, la reducción de leucocitos totales circulantes, puede perjudicar la respuesta al ataque a este según antígeno/local. Eso puede ser principalmente peligroso cuando la tasa de leucocitos totales en la sangre está muy baja (leucopenia). En el análisis del referido estudio, el grupo infectado y suplementado con Immunowall® proporcionó una menor movilización de los leucocitos de la sangre hacia el intestino a los 14 días; sin embargo, cuando ese sistema inmune se subdividió y se analizaron las diferentes células, los animales de este grupo presentaron más APC’s, monocitos supresores (impiden una respuesta inmune desenfrenada), y linfocitos T auxiliares (CD4 – secretan interleucinas y estimulan la multiplicación de células que van a atacar al antígeno), que el grupo de animales desafiados y no tratados. Ya el grupo suplementado con ImmunoWall® y no desafiado, presentó respuestas intermediarias (entre el control desafiado y el no desafiado) a las células analizadas citadas arriba, y también Linfocitos T citotóxicos (CD8), que son importantes para prevenir o controlar la invasión de Salmonella, ya que estas tienen la capacidad de invadir monocitos y así translocarse hacia el hígado y demás órganos.
En el gráfico 1 abajo, es posible observar que la suplementación con ImmunoWall® ha resultado en la mayor producción IgA anti Salmonella a los 14 días de edad. Eso muestra que la respuesta específica del sistema inmunológico fue más rápida y más fuerte, consumiendo menos energía y nutrientes, ya que la respuesta inflamatoria pareció ser más corta.
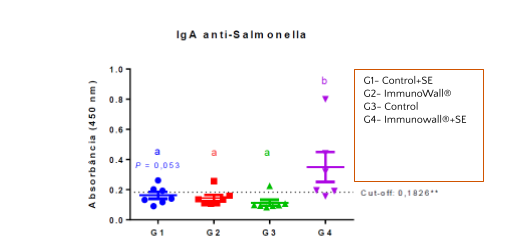
Gráfico 1. Cuantificación relativa de IgA en el suero reactivo contra LPS de la bacteria. La línea de corte (cut-off) está representada. Relevancia estadística está indicada por letras diferentes sobre cada grupo. Test de ANOVA con post-test de Tukey (P<0,05, excepto cuando indicado en contrario).
La SE puede ser un problema para el ave que todavía no ha completado la maturación del sistema inmune, pues todavía no consigue controlar la infección totalmente, por eso gran parte de la mejoría de las respuestas encontradas en este estudio fueron hasta los 14 días. Así, la suplementación de β-glucanos puede ayudar el ave a tener una activación y respuesta del sistema inmune innato precoz y más rápida, reduciendo /minimizando los daños causados por el patógeno y consecuentemente, las pérdidas en desempeño. Este tipo de respuesta es especialmente importante en animales en fases iniciales de desarrollo, reproductivas, períodos de estrés y desafíos ambientales; actuando como un profiláctico y aumentando la resistencia animal, minimizando mayores perjuicios.
Diversos otros estudios probaron la eficacia de ImmunoWall® en reducir la contaminación de patógenos en las aves y huevos (Hofacre et al., 2017; Ferreira et al., 2014), mortalidad y mejorar el desempeño productivo (Bonato et al., 2016; Rivera et al., 2018; Koiyama, et al. 2018). No existen aditivos alimentares que puedan suplir problemas con manejo, plan sanitario, vacunación, nutrición, calidad de agua, entre otros; los aditivos son herramientas que pueden ayudar en el control y prevención. Sabemos que la producción animal intensiva es un ambiente altamente desafiador, así que el fortalecimiento del sistema inmunológico puede ser una de las llaves para mayor productividad.
Referencias
Beirão B. C. B. et al. Yeast cell wall immunomodulatory and intestinal integrity effects on broilers challenged with Salmonella Enteritidis. In: 2018 PSA Annual Meeting. San Antonio-Texas, USA. Proceedings…. 2018.
Bonato et al. Desempenho de frangos de corte alimentados com mananoligossacarídeos, parede celular de levedura e nucleotídeos de diferentes fontes. In: Conferência FACTA 2016 de Ciência e Tecnologia Avícolas, Atibaia. Proceedings.2016.
Dalloul, R. A., H. S. Lillihoj. Poultry coccidiosis: recent developments in control measures and vaccine development. Expert Rev. Vaccines, v. 5, p.143-163, 2006.
Ferreira, A.J.P. et al. Uso da associação de levedura e fonte de nucleotídeos na redução da colonização entérica por Salmonella Hiedelberg em frangos. In: Conferência FACTA 2014 de Ciência e Tecnologia Avícolas, Atibaia. Proceedings…. 2014.
Hofacre, C., et al. Use of a yeast cell wall product in commercial layer feed to reduce S.E. colonization. Proceedings of 66th Western Poultry Disease Conference, March 2017, Sacramento, CA, p. 76-78, 2017.
Koiyama, et al. Effect of yeast cell wall supplementation in laying hen feed on economic viability, egg production, and egg quality. The Journal of Applied Poultry Research, v. 27 (1), p. 116–123, 2018.
Lee, H. K., A. Iwasaki. Innate control of adaptive immunity: dendritic cells and beyond. Semin. Immunol., n. 19, p.48-55, 2007.
Petravić-Tominac, V. et al. Biological effects of yeast β-glucans. Agriculturae Conspectus Scientificus, n. 75, v. 4, 2010.
Rivera et al. Yeast cell wall and hydrolyzed yeast as a source of nucleotides effects on immunity, gut integrity and performance of broilers. In: 2018 International Poultry Scientific Forum. Atlanta-GA, USA. Proceedings…. p. 49, 2018.
Rocha, T.M., Andrade, M.A., Santana, E.S., Fayad, A.R., Matias, T.D. Aspectos clínicos, patológicos e epidemiológicos de doenças imunossupressoras em aves. Enciclopédia Biosfera, Centro Científico Conhecer, v.10, n.18, p. 25, 2014.
Sharma, J. M. The avian immune system. In: Saif, Y. M. (ed.), Diseases of Poultry, 11th ed., pp. 5-16. Iowa State Press, Ames, IA, 2003.
Publicado en 05 octubre de 2021


